Traduction d’un article de Stefano Pettinelli et al. paru en octobre 2023 dans la revue Chemical and Biological Technologies in Agriculture. DOI:10.1186/s40538-023-00492-7
Titre original : Is there any influence of biodynamic preparation 501 on the physiological activity of grape leaves cv. Cesanese d’Affile?
Résumé
Contexte
L’agriculture biodynamique est un mode de culture qui vise à réduire la dépendance à l’égard des produits phytosanitaires en mettant l’accent sur l’utilisation de préparations naturelles spécifiques. Un essai en plein champ sur 2 ans (2019-2020) a été mené dans un vignoble (Vitis vinifera L., cv. Cesanese d’Affile) pour étudier les effets de la préparation biodynamique « silice de corne » (BD-501) sur la physiologie et la résistance des feuilles de vigne, via l’activité de la chitinase et l’analyse des métabolites secondaires. Le vignoble en culture biodynamique a été divisé en deux parcelles : l’une traitée avec de la silice de corne (BD-501) et l’autre non traitée (BD). Tout au long de la saison de croissance de la vigne, la teneur en caroténoïdes et en chlorophylle, les polyphénols et l’activité de la chitinase ont été mesurés au cours de phases phénologiques clés (échelle BBCH). Pendant la phase de maturation, un fluoromètre a été utilisé pour évaluer la fluorescence de la chlorophylle dans les feuilles.
Résultats
Les feuilles traitées avec le BD-501 ont présenté des concentrations élevées de polyphénols et une activité accrue de la chitinase au cours des dernières phases phénologiques. En revanche, les échantillons non traités ont montré des valeurs élevées principalement dans la phase centrale de la période d’observation, mais pas de manière constante tout au long de la saison. Au moment de la récolte, la concentration de chlorophylle et le rendement quantique de la photosynthèse ne présentaient pas de différences statistiquement significatives. La modalité BD-501 a déclenché une réponse distincte en termes de mécanismes de défense potentiels (augmentation des polyphénols et de l’activité de la chitinase) au cours de la phase de véraison. Cependant, des niveaux inférieurs de chlorophylle et de caroténoïdes ont été observés.
Conclusions
Néanmoins, une nouvelle série de travaux expérimentaux est nécessaire pour bien comprendre les mécanismes de régulation à l’origine de cette réponse adaptative et pour confirmer l’efficacité du BD-501.
Contexte
Les pratiques agronomiques alternatives, telles que l’agriculture biologique et biodynamique, ont été favorisées par la sensibilisation croissante des consommateurs à la dégradation de l’environnement dans l’agriculture et à l’importance de la qualité des aliments pour la santé humaine [1, 2]. D’une manière générale, l’agriculture biodynamique se distingue de l’agriculture biologique traditionnelle par l’utilisation de préparations fermentées spécifiques proposées par Rudolf Steiner (1861-1925), censées stimuler le cycle des nutriments du sol et renforcer l’efficacité de l’activité foliaire ainsi que l’évolution optimale du compost, améliorant ainsi la qualité du sol et des cultures [2, 3]. Ces traitements, appliqués aux cultures, au compost et au sol, se sont révélés efficaces pour améliorer la qualité des cultures et des animaux tout en favorisant un cycle nutritif efficace. Les agrosystèmes gérés de manière biodynamique sont considérés comme ayant des effets positifs sur l’environnement en termes d’efficacité énergétique [3,4,5].
En ce qui concerne la qualité des vins issus de la viticulture et de la vinification biodynamiques, quelques articles ont été publiés, notamment par un groupe italien, comparant la qualité des vins conventionnels et biodynamiques [6,7,8,9]. Dans les vignobles, certaines études ont été menées pour mieux comprendre les effets des préparations/méthodes sur la physiologie de la vigne et sur le rendement [5, 10, 11]. En ce qui concerne la réponse physiologique de la vigne, on a constaté une meilleure activité enzymatique de la chitinase et de la β-1,3-glucanase avec la méthode biodynamique [10], alors que pour le rendement, des valeurs similaires ont été trouvées par rapport à la méthode biologique [4, 5, 12]. D’autres études [12, 13, 14] ont montré que les baies issues de vignes cultivées en biodynamie présentaient un niveau plus élevé de solides solubles, de phénols totaux et d’anthocyanes dans le raisin rouge, tandis que dans le raisin blanc, aucune différence n’a été détectée en ce qui concerne les solides solubles, le pH et l’acidité totale.
Une autre étude [11] a utilisé la spectroscopie de résonance magnétique nucléaire à haute résolution (HR-NMR) pour révéler les différences entre les métabolomes des vins rouges biologiques et biodynamiques, à l’aide d’une analyse multivariée. Elle a confirmé la présence de différences spécifiques statistiquement significatives.
L’agriculture biodynamique est gérée selon les normes Demeter, pour produire des produits labellisés Demeter ou Biodynamic®. Pour obtenir l’autorisation d’utiliser la marque, il faut respecter le règlement 834/0715, remplacé par le règlement 889/0816, relatif à la production biologique, ainsi que les normes Demeter de production, de transformation, de distribution et d’étiquetage [15].
Après l’oxygène, la silice (Si) est le deuxième élément le plus présent sur la planète et constitue 26 à 27 % de la croûte terrestre [16]. Dans le sol, elle se présente normalement sous la forme d’acide silicique (H4SiO4) et, tout comme le potassium, le calcium et d’autres éléments, elle est considérée comme essentielle à la nutrition végétale [17, 18]. Chez les plantes, elle est absorbée et atteint des concentrations qui varient entre 1 et 10 % de la matière sèche, à l’exception des Equisetaceae qui atteignent des valeurs encore supérieures [19]. Le Si peut être incorporé dans la paroi cellulaire par réticulation avec d’autres constituants de la paroi tels que les hémicelluloses, les pectines et les phénols dans les tissus endo- et exo-dermiques des racines [20, 21]. Le Si est transporté du sol vers la plante sous forme d’acide silicique qui est souvent limitant dans le sol [22], et deux transporteurs, Lsi1 et Lsi2, en sont responsables et sont situés dans la racine absorbante [23,24,25]. Le transporteur Lis6, homologue de Lsi1, est nécessaire pour décharger l’acide silicique du xylème dans toutes les cellules végétales [26, 27].
De nombreux rapports présentent le Si comme un nutriment végétal bénéfique pour stimuler la croissance et le rendement de différentes cultures [28,29,30]. Par conséquent, le Si joue un rôle vital dans l’atténuation des effets négatifs du stress de la sécheresse [17, 31, 32]. Il est largement admis que la silice contribue à la résistance au stress par deux processus clés : (i) la protection physique et mécanique du Si déposé dans la paroi cellulaire, qui réduit la conductance stomatique et la transpiration des feuilles ; (ii) une réaction biochimique provoquant des changements métaboliques [33].
Une autre fonction du Si est corrélée à son activité de réduction des dommages causés par les insectes [28, 34, 35]. Par conséquent, le Si est un remède possible pour réduire l’utilisation intensive des pesticides, puisqu’il s’agit d’une alternative naturelle respectueuse de l’environnement, qui ne constitue pas une menace pour la santé humaine et l’environnement [18, 36].
Chez les plantes, après avoir été absorbé et accumulé, le Si est ensuite transporté vers la partie externe de la paroi cellulaire de l’épiderme ou dans les trichomes des feuilles. En outre, il est établi que le Si favorise la division et l’élargissement des cellules, contrôle les processus physiologiques et les activités métaboliques telles que la perméabilité des membranes, l’absorption de l’eau et des nutriments, la photosynthèse, la transpiration et la biosynthèse des phytohormones [31, 37, 38].
La présente recherche postule que l’utilisation de la préparation 501, dérivée de la silice de corne, pourrait avoir un impact sur l’activité physiologique des feuilles de vigne tout en induisant potentiellement un mécanisme de résistance. Cette étude a duré deux ans et a été menée dans un vignoble exploité de manière biodynamique depuis de nombreuses années.
Gestion du vignoble et conditions climatiques
Le site expérimental est un vignoble ancien situé à Piglio (Frosinone, Lazio), Italie (41° 49′ 45″ 84 N, 13° 7′ 23″ 88 E, 430 m d’altitude), planté en 1965 avec le cépage Cesanese d’Affile (Vitis vinifera L.), greffé sur 1103 Paulsen, palissé en guyot. Le vignoble étudié est en pente, avec des rangs orientés sud/nord et en descente. Les vignes sont espacées de 2,2 m × 1,2 m, avec une densité de 3787 plantes/ha. La région de Piglio se caractérise par un territoire montagneux et vallonné, avec des sols très riches. Le Cesanese d’Affile est le seul cépage rouge autorisé dans la région de Lazio pour la production de vins AOP. Depuis 2012, ce vignoble est géré et certifié biologique conformément au règlement (CE) n° 834/2007. Au cours des saisons 2019 et 2020, le nombre de bourgeons (10-12) de la vigne a été ajusté par la taille hivernale. Les couverts végétaux composés de fève (Vicia faba), de trèfle souterrain (Trifolium subterraneous), de pois (Pisum sativum) et de ray-grass annuel (Lolium multiflorum) ont été semés dans les rangs à la fin de chaque saison végétative, dans les deux traitements. Aucune irrigation n’a été appliquée au cours des deux saisons. En utilisant des produits biologiques autorisés par le règlement (CE) n° 1112/2002, l’ensemble de la parcelle a été traité de la même manière pour lutter contre les maladies et les ravageurs. Le traitement comprenait principalement du cuivre (en moyenne 5 kg/ha par an) et du soufre (en moyenne 7 kg/ha par an), ce qui a permis de maîtriser les champignons pathogènes.
Au cours de la saison végétative 2019, les températures ont été supérieures aux normales saisonnières, le mois d’août ayant connu les pics de température les plus élevés (35 °C). L’humidité relative (HR) moyenne a varié de 40 à 70 % du débourrement à la récolte ; les valeurs les plus élevées ont été notées en mai (85 %), ce qui était inattendu, et les plus faibles (33 %) en août, ce qui était prévu. Les précipitations totales (250 mm) du débourrement à la récolte ont été concentrées principalement en mai et au moment de la maturation, en septembre. En 2020, il y a eu une augmentation des températures par rapport à la moyenne de mars (T moyenne : 23 °C) avec une baisse ultérieure en avril où le gel et le froid se sont produits dans les zones de plaine, mais cela n’a pas affecté les vignobles de l’expérimentation. Les mois de juillet et d’août ont été très chauds (plusieurs jours à 35 °C) et sans pluie. L’humidité relative entre le débourrement et la récolte a varié de 30 à 82 %, avec des pics plus élevés en juillet et en septembre. Les précipitations totales (330 mm), enregistrées du débourrement à la récolte, ont eu lieu principalement au printemps.
Conception expérimentale
En 2019, la superficie de 0,4 ha a été divisée en deux grands blocs uniformes présentant des caractéristiques pédologiques similaires [la couche de sol de 0-0,4 m était un limon argileux (Aquic Haplustepts, fin, mixte, mésique), subalcalin (pH 8,0), et contenait 14,0 g/kg de carbone organique total, 1,1 g/kg d’azote total, et 7,4 mg/kg de phosphore assimilable]. Chaque bloc a été utilisé pour tester une méthode spécifique de culture : (i) agriculture biodynamique [BD-501], basée sur une gestion biodynamique avec l’application de la préparation de silice de corne 501 selon les normes Demeter (organisme de certification biodynamique) ; (ii) [BD] basée sur la même gestion mais sans l’application de la BD-501. Chaque traitement a été appliqué sur 4 parcelles (2 parcelles par type de traitement), contenant chacune 30 ceps, pour un total de 120 ceps. Entre les deux blocs, deux rangées de vignes ont été laissées et n’ont pas été prises en compte dans l’expérimentation.
Les préparations biodynamiques de bouse de corne (500) et de silice de corne (501) ont été produites par l’Azienda agricola biodinamica Carlo Noro (Labico, Italie). Ces préparations ont été préparées conformément au protocole Demeter (Fédération biodynamique Demeter International E.V. Brandschneise 1D-64295 Darmstadt, DE). La silice de corne, qui a fait l’objet du travail expérimental, a été pulvérisée sur les vignes à l’aide d’un atomiseur à dos, avec une buse à faible consommation d’eau, tôt le matin, sans brise ni vent. En 2019 et 2020, trois applications de la préparation 500 ont été effectuées au printemps sur l’ensemble du vignoble. Trois applications de la préparation 501 ont été effectuées dans les deux blocs, une au printemps et deux en été, uniquement dans le bloc nommé BD-501. Les blocs sans traitement 501, nommés BD, ont été utilisés comme contrôle pour évaluer l’effet de la préparation. Les périodes d’application ont été choisies en fonction des conditions environnementales et de l’état phénologique des plantes. Six feuilles par plante ont été échantillonnées en haut, au milieu et en bas du pied de vigne. Au total, 60 plantes par traitement (BD-501 ou BD), soit un total de 360 feuilles pour chaque phase phénologique, ont été utilisées. L’échantillonnage a été réalisé au cours de 3 phases phénologiques différentes : au début de la croissance des baies (BBCH 71), à la fermeture des grappes (BBCH 79) et lorsque les baies étaient partiellement rouges (BBCH 83).
Méthodes d’analyses
Le détail des outils et méthodes utilisés pour les analyses chimiques, enzymatiques, physiologiques et photochimiques, ainsi que les protocoles statistiques, sont présentés dans l’article original (non traduit).
Résultats et discussion
Chlorophylles et caroténoïdes
Les valeurs de la teneur en chlorophylle (Chl) exprimées en μg/g de matière sèche dans les deux années, ont diminué de façon linéaire au cours des phases phénologiques, indépendamment du traitement (Tableau 1).
Tableau 1 Pigments foliaires (caroténoïdes et chlorophylle) mesurés au cours de trois phases phénologiques du développement des raisins, au cours des deux années d’étude.
| Treatment | Phenological phases | Car (μg/g fw) | Chl-a (μg/g fw) | Chl-b (μg/g fw) | Total Chl (μg/g fw) | Ratio (% a/b) |
|---|---|---|---|---|---|---|
| 2019 | ||||||
| BD-501 | BBCH 71 | 11.91bc | 497.90b | 211.75b | 709.65b | 2.35bc |
| BBCH 79 | 15.32a | 459.17bc | 187.16b | 646.32b | 2.45b | |
| BBCH 83 | 12.87b | 403.85c | 149.65c | 553.50c | 2.69ab | |
| BD | BBCH 71 | 13.05b | 617.43a | 261.19a | 878.62a | 2.36bc |
| BBCH 79 | 13.45ab | 603.77a | 257.71a | 861.62a | 2.34c | |
| BBCH 83 | 10.21c | 338.02d | 121.59d | 459.61d | 2.77a | |
| 2020 | ||||||
| BD-501 | BBCH 71 | 12.68b | 503.43b | 227.63b | 731.06b | 2.21ab |
| BBCH 79 | 15.82a | 482.36bc | 207.65bc | 690.01b | 2.32a | |
| BBCH 83 | 14.03ab | 409.89c | 181.56c | 591.45c | 2.25ab | |
| BD | BBCH 71 | 13.25b | 622.43a | 289.13a | 911.79a | 2.15b |
| BBCH 79 | 13.72b | 613.12a | 276.65a | 890.32a | 2.21ab | |
| BBCH 83 | 10.18c | 331.35d | 139.67d | 471.03d | 2.37a | |
Dans certaines phases phénologiques, les teneurs diffèrent significativement les unes des autres, bien qu’aucune disparité substantielle n’ait été observée. Dans les feuilles de l’échantillon BD, on a mesuré une forte diminution de la Chl à BBCH 83 par rapport à la phase précédente. La deuxième année, les teneurs en Chl étaient plus élevées que l’année précédente (tableau 1). Les feuilles du traitement BD-501 ont montré une teneur en Chl plus faible au cours des deux premières phases phénologiques mais, au cours de la dernière phase phénologique, la valeur a augmenté, atteignant la valeur la plus élevée (tableau 1).
En comparant les concentrations de Chl-b entre les deux années, il est possible d’observer dans le tableau 1 une tendance à la baisse des valeurs ; dans la première phase phénologique, les feuilles du traitement BD-501 ont des valeurs plus élevées que dans les deux autres phases. Les deux systèmes de conduite ont montré une tendance à la baisse de la teneur en Chl. Cependant, on peut noter que, dans la phase de fermeture de la grappe, les valeurs de Chl du traitement BD sont inférieures à celles du traitement BD-501. Les feuilles du bloc BD-501 n’ont pas subi la forte diminution à laquelle les feuilles de BD sont soumises dans la phase BBCH 83. Ceci met en évidence la capacité de la 501 à conserver une teneur plus élevée en pigments au fil du temps. En fait, les applications foliaires de Si augmentent la teneur en Chl, en la préservant des antioxydants enzymatiques et non enzymatiques, que ce soit dans de bonnes conditions hydriques ou en situation de déficit, par rapport aux témoins respectifs (pulvérisés avec de l’eau distillée) [43]. Dans un travail réalisé par Malagoli et al [44] concernant l’application du BD-501, les résultats de la teneur en Chl-a et Chl-b étaient plus élevés dans les plantes traitées avec la silice de corne que dans les plantes non traitées.
La somme des deux pigments de chlorophylle indique que la synthèse des pigments est plus importante, tandis que le rapport indique si, d’une certaine manière, le stress hydrique stimule une plus grande synthèse des pigments. En effet, dans des conditions de stress hydrique et thermique, c’est-à-dire un stress qui affecte le potentiel osmotique de la feuille, les pigments subissent une diminution de leur valeur, mais la Chl-b diminue plus que la Chl-a, et le rapport a/b Chl augmente. Avec l’augmentation du rayonnement solaire, l’un des moyens utilisés par la plante pour résister au changement climatique est d’induire une synthèse plus faible de chlorophylle.
Il a été démontré que l’ajout de Si sur d’autres cultures entraîne une accumulation plus importante de Chl et d’autres pigments, tant chez les accumulateurs de Si comme le riz [23, 45] et le blé [46], que chez les non-accumulateurs de Si comme la tomate [47, 48]. L’un des effets les plus significatifs de l’apport de Si à des plantes soumises à un stress salin dans toutes ces conditions d’essai a été l’augmentation de la teneur en chlorophylle. Cependant, l’augmentation de la Chl provoquée par la fertilisation au Si varie selon les espèces et les cultivars et n’est pas toujours appréciable [49,50,51]. Le Si peut avoir un impact plus direct sur la photosynthèse par une meilleure distribution de la lumière à travers les photosystèmes et une augmentation de l’efficacité quantique qui en résulte [47] ; cependant, aucune explication moléculaire de ce phénomène n’a été proposée.
Les principaux transporteurs de silicium, à savoir Lsi1 et Lsi6, jouent un rôle crucial dans la distribution du silicium dans les tissus des racines et des tiges [26]. En revanche, Lsi2 fonctionne comme un transporteur d’anions putatif, principalement exprimé dans l’endoderme des racines [23, 24].
Les concentrations de chlorophylle (Chl) subissent une réduction et, selon la littérature existante, la dégradation de la chlorophylle constitue un aspect essentiel du recyclage de l’azote. Ce processus joue un rôle important dans la prévention des dommages cellulaires. Lorsque la dégradation de la chlorophylle n’est pas régulée de manière adéquate, elle entraîne de sérieux dommages dus à la lumière et déclenche la mort cellulaire [52,53,54].
En comparant les concentrations de chlorophylle totale et de caroténoïdes au fil du temps, l’échantillon BD-501 montre une diminution des concentrations au fur et à mesure que les phases phénologiques progressent. En effet, le système BD-501 reste partiellement constant jusqu’au stade BBCH 71 et baisse ensuite d’environ 20 % jusqu’au stade BBCH 83, alors que le BD connaît une chute de plus de 40 %. En analysant le rapport de la somme entre les deux pigments, il n’y a pas de différences significatives entre le contenu de Chl à l’intérieur des feuilles, mais seulement une diminution dans la phase finale proche de la véraison (BBCH 83) dans laquelle le système BD a les valeurs les plus basses (Tableau 1). Par conséquent, le système BD-501 maintient les valeurs les plus élevées de chlorophylles au fil du temps, ce qui se traduit par une plus grande efficacité dans le maintien de la teneur en pigments photosynthétiques.
Les caroténoïdes permettent l’absorption de photons de longueurs d’onde autres que celles des pigments chlorophylliens et les protègent de la photo-oxydation [55]. De plus, ils jouent un rôle important dans la synthèse des hormones végétales liées au stress puisqu’ils sont les précurseurs de phytohormones telles que l’ABA et les strigolactones [56, 57]. En analysant la première année, au stade BBCH 71, les concentrations montrent des valeurs similaires et dans la phase suivante, elles subissent une augmentation dans les deux traitements (tableau 1). Les feuilles traitées avec la BD-501 subissent une augmentation plus forte que les feuilles traitées en BD au stade BBCH 79, puis une diminution à BBCH 83 (Tableau 1). Au cours de la deuxième année, un comportement analogue est observé. Au stade BBCH 71, la feuille traitée avec BD-501 a la valeur la plus basse par rapport à la feuille traitée en BD (Tableau 1). Au stade BBCH 79, les caroténoïdes dans les feuilles des deux traitements sont soumis à une augmentation, mais dans la phase suivante, ils présentent des valeurs statistiques plus faibles, puisqu’il n’y a pas de lien univoque entre les données, mais seulement cette augmentation pendant la fermeture de la grappe. Les feuilles traitées avec la BD-501 présentent la valeur la plus élevée dans la dernière phase pour les deux années.
Polyphénols
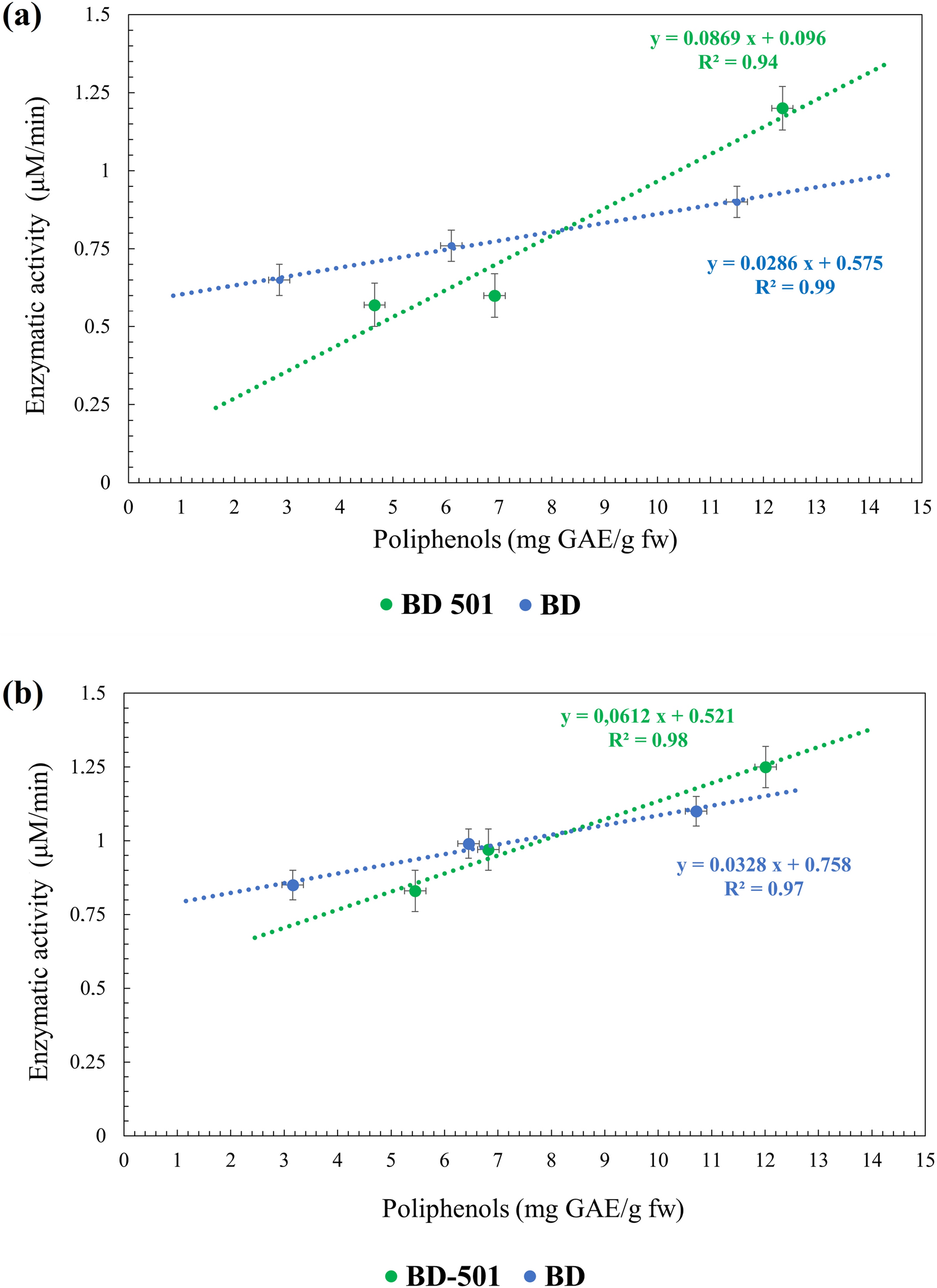
La teneur en polyphénols des feuilles a montré des valeurs croissantes à partir de la phase BBCH 71 (Tableau 2) dans les deux années, et un comportement analogue est mesuré. Il n’y a pas de différence substantielle entre les 2 années analysées, ce qui témoigne que la voie de synthèse de ces molécules n’a pas été sujette à variation entre les 2 années d’analyse.
Tableau 2. Polyphénols et activité enzymatique (chitinase) mesurés au cours des trois phases phénologiques du développement des raisins, au cours des deux années de l’étude.
| Treatment | Phenological phases | Enzymatic activity (μM/min) | Polyphenols (mg GAE/g fw) |
|---|---|---|---|
| 2019 | |||
| BD-501 | BBCH 71 | 0.60c | 6.92b |
| BBCH 79 | 0.57c | 4.65c | |
| BBCH 83 | 1.20a | 12.36a | |
| BD | BBCH 71 | 0.65bc | 2.85d |
| BBCH 79 | 0.76bc | 6.10bc | |
| BBCH 83 | 0.90b | 11.50a | |
| 2020 | |||
| BD-501 | BBCH 71 | 0.83c | 5.45b |
| BBCH 79 | 0.97bc | 6.82b | |
| BBCH 83 | 1.25a | 12.01a | |
| BD | BBCH 71 | 0.85c | 3.16c |
| BBCH 79 | 0.99bc | 6.45b | |
| BBCH 83 | 1.10ab | 10.71a | |
A la première phase analysée, une valeur élevée de ces composés est détectable dans la feuille traitée avec la préparation BD-501 par rapport à la BD. La dernière phase (BBCH 83) est caractérisée par une augmentation de la quantité de polyphénols dans la feuille traitée avec la préparation BD-501, qui a la valeur la plus élevée (Tableau 2).
Le système biodynamique 501 semble favoriser et stimuler la production de polyphénols. En effet, selon la littérature, des mécanismes biochimiques/moléculaires sont induits ou renforcés par le Si, ce qui permet à la plante d’améliorer sa résistance au stress biotique et d’inclure des composés défensifs tels que les phénols, les phytoalexines et les momilactones [58]. En fait, il a été démontré que les nanoparticules de silice protègent les semis de blé contre le stress UV-B en stimulant le système de défense antioxydant [59].
Fawe et al [60] ont détecté et identifié des flavonoïdes et des acides phénoliques qui ont été spécifiquement et fortement activés dans une configuration typique des phytoalexines, à la suite du traitement au Si. On a donc supposé que le Si jouait un rôle actif dans la résistance aux maladies en stimulant les mécanismes de défense [61].
Il est connu qu’une plus grande tolérance des plantes aux stress abiotiques est liée à une synthèse accrue des polyphénols, tels que les acides phénoliques et les flavonoïdes [62].
Malagoli et al [44] affirment que l’application de la préparation 501 peut déclencher la biosynthèse d’antioxydants bénéfiques pour améliorer la tolérance au stress des plants de vigne, bien que les différentes variations des niveaux de métabolites foliaires enregistrés dans les plantes puissent être attribuées à l’effet de site des vignobles.
Activité enzymatique
L’activité de la chitinase a globalement augmenté au cours des phases phénologiques et a suivi une tendance linéaire croissante (Tableau 2). La première année, pendant la phase BBCH 71, les valeurs moyennes sont très similaires entre les deux échantillons ; pendant la phase BBCH 83, on observe une augmentation dans les feuilles des deux traitements et celles traitées avec la préparation BD-501 ont les valeurs les plus élevées. Au cours de la deuxième année, les feuilles traitées dans les modalités BD et BD-501 ont montré une activité plus élevée par rapport à l’année précédente et il y a une tendance linéaire à l’augmentation depuis le début. Les feuilles traitées avec BD-501 ont présenté les valeurs les plus élevées au cours de la phase de maturation, BBCH 83.
La chitinase est une enzyme hydrolytique capable de rompre les liaisons glycosidiques présentes dans la chitine, un homopolysaccharide présent dans de nombreux êtres vivants. Les chitinases extractibles de V. vinifera peuvent être classées en six groupes en fonction de la structure et de l’homologie entre les différents isoformes [63,64,65]. La chitinase est impliquée dans les processus de défense de la plante contre les champignons pathogènes et hydrolyse le principal polysaccharide fibrillaire de la paroi fongique. Les produits de dégradation de la chitine sont libérés et convertis en chitosane, une molécule qui joue un rôle clé dans les mécanismes de résistance. En effet, c’est un éliciteur, promoteur de l’activité de la lipoxygénase (LOX), une enzyme qui joue un rôle important dans les réponses hypersensibles, de l’ammonium phénylalanine (PAL), une enzyme qui intervient dans les voies métaboliques de synthèse des polyphénols et parmi eux des précurseurs des phytoalexines et de l’acide salicylique, et de la chitinase elle-même [66].
Les plantes du vignoble traité avec la préparation BD-501 montrent une forte augmentation de l’activité enzymatique au stade final (BBCH 83) dans les deux années (Tableau 2). Cet effet et son association avec le traitement biodynamique soutiendraient la thèse selon laquelle la préparation BD-501 est capable de stimuler les mécanismes de défense des plantes [3]. Le traitement pourrait en réalité avoir favorisé les plantes sur lesquelles il a été appliqué, en stimulant une plus grande capacité d’absorption de la lumière et donc une avancée de la maturation par rapport au contrôle. Nous avons découvert dans la littérature que le Si réduit les dommages oxydatifs de 30 % en moyenne, tant en cas de salinité que de sécheresse. Ceci est probablement dû à une augmentation de l’activité des enzymes antioxydantes, qui a augmenté en moyenne de 50 % en cas de stress salin et de 20 % dans le cas d’un stress hydrique [67].
Ma et al [25] ont démontré que le traitement au Si était lié à une augmentation de l’expression des gènes du stress oxydatif. Les modèles explicatifs mécanistes, cependant, nous sont encore totalement inconnus ; des voies post transcriptionnelles ou transcriptionnelles peuvent être utilisées pour stimuler l’activité enzymatique. Ces deux voies nécessiteraient des interactions moléculaires cytosoliques [31].
Par conséquent, plusieurs études ont établi un lien entre le Si et l’augmentation de l’activité antioxydante des pousses et des racines, qu’elle soit enzymatique (par exemple, superoxyde dismutase, peroxydase, catalase, ascorbate peroxydase et glutathion réductase) ou non enzymatique (par exemple, ascorbate, glutathion réductase et glutathion réductase), ainsi que des changements dans les concentrations des marqueurs usuels du stress oxydatif, y compris le malondialdéhyde, le peroxyde d’hydrogène (H2O2) et la proline, dans diverses conditions de stress abiotique [68, 69].
On peut en déduire que l’échantillon BD-501 montre une augmentation de l’activité de la chitinase au fil du temps, dans les différentes phases phénologiques, ce qui pourrait favoriser la résistance aux maladies fongiques, en particulier dans les phases finales de la maturation du raisin. Une corrélation importante entre l’activité enzymatique et le contenu en polyphénols est présente tout au long des deux années expérimentales (Fig. 1a, b).
Mesures physiologiques et photochimiques
L’efficacité photosynthétique (QY) et la conductance stomatique (gs) au moment de la maturation des baies (BBCH89) n’ont pas montré de différences significatives, présentant des valeurs moyennes analogues au cours des deux années (tableau 3). De même, la concertation de la chlorophylle foliaire pour les deux traitements étudiés n’a pas montré de différences significatives au cours des deux années d’étude.
Tableau 3 Valeurs des analyses non destructives [chlorophylle (Chl), rendement quantique (QY) et conductance stomatique (gs)] réalisées directement sur les feuilles au champ immédiatement avant la récolte (BBCH 89)
| Treatment | Phenological phases | Chl (µmol/m2) | QY (mol/mol quanta) | gs (µmol H20/m2 s) |
|---|---|---|---|---|
| 2019 | ||||
| BD-501 | BBCH 89 | 275.51a | 0.36a | 489.58a |
| BD | BBCH 89 | 237.39b | 0.40a | 499.21a |
| 2020 | ||||
| BD-501 | BBCH 89 | 291.22a | 0.37a | 459.01a |
| BD | BBCH 89 | 263.82b | 0.38a | 417.61a |
Conclusions
Les résultats obtenus par ce travail de recherche ont montré que l’application de la préparation BD-501 semble avoir des effets sur la physiologie de la plante pendant les phases de croissance végétative dans les deux années d’étude. Parmi les composants foliaires analysés, nous avons observé que la quantité de polyphénols augmentait de manière linéaire, atteignant la concentration la plus élevée au début de la phase de véraison, en même temps que la diminution des teneurs en chlorophylles. L’activité de la chitinase a également augmenté et les valeurs détectées dans les feuilles traitées avec la pré BD-501 pourraient être attribuées à l’induction promotrice du silicium.
Références
- Pettinelli S, Pardini L, De Angeli G, Bianchi A, Najar B, Cerreta R, et al. Innovative “Soft” maceration techniques in red grape fermentation. Beverages. 2022;8:62. https://doi.org/10.3390/beverages8040062.Article CAS Google Scholar
- Brock C, Geier U, Greiner R, Olbrich-Majer M, Fritz J. Research in biodynamic food and farming—a review. Open Agric. 2019;4:743–57. https://doi.org/10.1515/opag-2019-0064.Article Google Scholar
- Turinek M, Grobelnik-Mlakar S, Bavec M, Bavec F. Biodynamic agriculture research progress and priorities. Renew Agric Food Syst. 2009;24:146–54. https://doi.org/10.1017/S174217050900252X.Article Google Scholar
- Döring J, Collins C, Frisch M, Kauer R. Organic and biodynamic viticulture affect biodiversity and properties of vine and wine: a systematic quantitative review. Am J Enol Vitic. 2019;70:221–42. https://doi.org/10.5344/ajev.2019.18047.Article CAS Google Scholar
- Döring J, Frisch M, Tittmann S, Stoll M, Kauer R. Growth, yield and fruit quality of grapevines under organic and biodynamic management. PLoS ONE. 2015;10:1–28. https://doi.org/10.1371/journal.pone.0138445.Article CAS Google Scholar
- Picchi M, Canuti V, Bertuccioli M, Zanoni B. The influence of conventional and biodynamic winemaking processes on the quality of sangiovese wine. Int J Wine Res. 2020;12:1–16. https://doi.org/10.2147/IJWR.S245183.Article Google Scholar
- Maioli F, Picchi M, Millarini V, Domizio P, Scozzafava G, Zanoni B, et al. A methodological approach to assess the effect of organic, biodynamic, and conventional production processes on the intrinsic and perceived quality of a typical wine: the case study of chianti DOCG. Foods. 2021;10:1894. https://doi.org/10.3390/foods10081894.Article PubMed PubMed Central CAS Google Scholar
- Parpinello GP, Rombolà AD, Simoni M, Versari A. Chemical and sensory characterisation of Sangiovese red wines: comparison between biodynamic and organic management. Food Chem. 2015;167:145–52. https://doi.org/10.1016/j.foodchem.2014.06.093.Article PubMed CAS Google Scholar
- Parpinello GP, Ricci A, Rombolà AD, Nigro G, Versari A. Comparison of Sangiovese wines obtained from stabilized organic and biodynamic vineyard management systems. Food Chem. 2019;283:499–507. https://doi.org/10.1016/j.foodchem.2019.01.073.Article PubMed CAS Google Scholar
- Botelho RV, Roberti R, Tessarin P, Garcia-Mina JM, Rombolà AD. Physiological responses of grapevines to biodynamic management. Renew Agric Food Syst. 2016;31:402–13. https://doi.org/10.1017/S1742170515000320.Article Google Scholar
- Picone G, Trimigno A, Tessarin P, Donnini S, Rombolà AD, Capozzi F. 1H NMR foodomics reveals that the biodynamic and the organic cultivation managements produce different grape berries (Vitis vinifera L. cv. Sangiovese). Food Chem. 2016;213:187–95. https://doi.org/10.1016/j.foodchem.2016.06.077.Article PubMed CAS Google Scholar
- Reeve JR, Carpenter-Boggs L, Reganold JP, York AL, McGourty G, McCloskey LP. Soil and winegrape quality in biodynamically and organically managed vineyards. Am J Enol Vitic. 2005;56:367–76. https://doi.org/10.5344/ajev.2005.56.4.367.Article CAS Google Scholar
- Tassoni A, Tango N, Ferri M. Polyphenol and biogenic amine profiles of Albana and Lambrusco grape berries and wines obtained following different agricultural and oenological practices. Food Nutr Sci. 2014;5:9. https://doi.org/10.4236/fns.2014.51002.Article CAS Google Scholar
- Tassoni A, Tango N, Ferri M. Comparison of biogenic amine and polyphenol profiles of grape berries and wines obtained following conventional, organic and biodynamic agricultural and oenological practices. Food Chem. 2013;139:405–13. https://doi.org/10.1016/j.foodchem.2013.01.041.Article PubMed CAS Google Scholar
- Zikeli S, Deil L, Möller K. The challenge of imbalanced nutrient flows in organic farming systems: a study of organic greenhouses in Southern Germany. Agric Ecosyst Environ. 2017;244:1–13. https://doi.org/10.1016/j.agee.2017.04.017.Article Google Scholar
- Datnoff LE, Snyder GH, Korndörfer GH. Silicon in agriculture. Amsterdam: Elsevier; 2001. Google Scholar
- Yavaş İ, Aydın Ü. The role of silicon under biotic and abiotic stress conditions. Türk Tarımsal Araştırmalar Derg. 2017;4:204–9. https://doi.org/10.19159/tutad.300023.Article Google Scholar
- Schaller J, Puppe D, Kaczorek D, Ellerbrock R, Sommer M. Silicon cycling in soils revisited. Plants. 2021. https://doi.org/10.3390/plants10020295.Article PubMed PubMed Central Google Scholar
- Epstein E. The anomaly of silicon in plant biology. Proc Natl Acad Sci. 1994;91:11–7. https://doi.org/10.1073/pnas.91.1.11.Article PubMed PubMed Central CAS Google Scholar
- Fleck AT, Schulze S, Hinrichs M, Specht A, Waßmann F, Schreiber L, et al. Silicon promotes exodermal casparian band formation in Si-accumulating and Si-excluding species by forming phenol complexes. PLoS ONE. 2015;10:1–18. https://doi.org/10.1371/journal.pone.0138555.Article CAS Google Scholar
- He C, Ma J, Wang L. A hemicellulose-bound form of silicon with potential to improve the mechanical properties and regeneration of the cell wall of rice. New Phytol. 2015;206:1051–62. https://doi.org/10.1111/nph.13282.Article PubMed CAS Google Scholar
- Côté-Beaulieu C, Chain F, Menzies JG, Kinrade SD, Bélanger RR. Absorption of aqueous inorganic and organic silicon compounds by wheat and their effect on growth and powdery mildew control. Environ Exp Bot. 2009;65:155–61. https://doi.org/10.1016/j.envexpbot.2008.09.003.Article CAS Google Scholar
- Ma JF, Yamaji N, Mitani N, Tamai K, Konishi S, Fujiwara T, et al. An efflux transporter of silicon in rice. Nature. 2007;448:209–12. https://doi.org/10.1038/nature05964.Article PubMed CAS Google Scholar
- Che J, Yamaji N, Shao JF, Ma JF, Shen RF. Silicon decreases both uptake and root-to-shoot translocation of manganese in rice. J Exp Bot. 2016;67:1535–44. https://doi.org/10.1093/jxb/erv545.Article PubMed PubMed Central CAS Google Scholar
- Ma D, Sun D, Wang C, Qin H, Ding H, Li Y, et al. Silicon application alleviates drought stress in wheat through transcriptional regulation of multiple antioxidant defense pathways. J Plant Growth Regul. 2016;35:1–10. https://doi.org/10.1007/s00344-015-9500-2.Article CAS Google Scholar
- Mitani N, Yamaji N, Ma JF. Identification of maize silicon influx transporters. Plant Cell Physiol. 2009;50:5–12. https://doi.org/10.1093/pcp/pcn110.Article PubMed CAS Google Scholar
- Yamaji N, Mitatni N, Ma JF. A Transporter regulating silicon distribution in rice shoots. Plant Cell. 2008;20:1381–9. https://doi.org/10.1105/tpc.108.059311.Article PubMed PubMed Central CAS Google Scholar
- Bakhat HF, Bibi N, Zia Z, Abbas S, Hammad HM, Fahad S, et al. Silicon mitigates biotic stresses in crop plants: a review. Crop Prot. 2018;104:21–34. https://doi.org/10.1016/j.cropro.2017.10.008.Article CAS Google Scholar
- Rizwan M, Ali S, Ibrahim M, Farid M, Adrees M, Bharwana SA, et al. Mechanisms of silicon-mediated alleviation of drought and salt stress in plants: a review. Environ Sci Pollut Res. 2015;22:15416–31. https://doi.org/10.1007/s11356-015-5305-x.Article CAS Google Scholar
- Shehata MN, Abdelgawad KF. Potassium silicate and amino acids improve growth, flowering and productivity of summer squash under high temperature condition. Am Eur J Agric Environ Sci. 2019;19:74–86. https://doi.org/10.5829/idosi.aejaes.2019.74.86.Article CAS Google Scholar
- Thorne SJ, Hartley SE, Maathuis FJM. Is silicon a panacea for alleviating drought and salt stress in crops? Front Plant Sci. 2020;11:1221. https://doi.org/10.3389/fpls.2020.01221.Article PubMed PubMed Central Google Scholar
- Tubana BS, Babu T, Datnoff LE. A review of silicon in soils and plants and its role in US agriculture: history and future perspectives. Soil Sci. 2016;181:393–411. https://doi.org/10.1097/SS.0000000000000179.Article CAS Google Scholar
- Luyckx M, Hausman J-F, Lutts S, Guerriero G. Silicon and plants: current knowledge and technological perspectives. Front Plant Sci. 2017. https://doi.org/10.3389/fpls.2017.00411.Article PubMed PubMed Central Google Scholar
- Kvedaras OL, Keeping MG. Silicon impedes stalk penetration by the borer Eldana saccharina in sugarcane. Entomol Exp Appl. 2007;125:103–10. https://doi.org/10.1111/j.1570-7458.2007.00604.x.Article CAS Google Scholar
- Massey FP, Ennos AR, Hartley SE. Silica in grasses as a defence against insect herbivores: contrasting effects on folivores and a phloem feeder. J Anim Ecol. 2006;75:595–603. https://doi.org/10.1111/j.1365-2656.2006.01082.x.Article PubMed Google Scholar
- Cataldo E, Fucile M, Mattii GB. Biostimulants in viticulture: a sustainable approach against biotic and abiotic stresses. Plants. 2022;11:162. https://doi.org/10.3390/plants11020162.Article PubMed PubMed Central CAS Google Scholar
- Zhu Y, Gong H. Beneficial effects of silicon on salt and drought tolerance in plants. Agron Sustain Dev. 2014;34:455–72. https://doi.org/10.1007/s13593-013-0194-1.Article CAS Google Scholar
- Jindo K, Goron TL, Pizarro-Tobías P, Sánchez-Monedero MÁ, Audette Y, Deolu-Ajayi AO, et al. Application of biostimulant products and biological control agents in sustainable viticulture: a review. Front Plant Sci. 2022;13:3657. https://doi.org/10.3389/fpls.2022.932311.Article Google Scholar
- Porra RJ, Thompson WA, Kriedemann PE. Determination of accurate extinction coefficients and simultaneous equations for assaying chlorophylls a and b extracted with four different solvents: verification of the concentration of chlorophyll standards by atomic absorption spectroscopy. Biochim Biophys Acta Bioenerg. 1989;975:384–94. https://doi.org/10.1016/S0005-2728(89)80347-0.Article CAS Google Scholar
- Yang C-M, Chang K-W, Yin M-H, Huang H-M. Methods for the determination of the chlorophylls and their derivatives. Taiwania. 1998;43:116–22. https://doi.org/10.6165/tai.1998.43(2).116.Article Google Scholar
- Bianchi A, Venturi F, Zinnai A, Taglieri I, Najar B, Macaluso M, et al. Valorization of an old variety of Triticum aestivum: a study of its suitability for breadmaking focusing on sensory and nutritional quality. Foods. 2023;12:1351. https://doi.org/10.3390/foods12061351.Article PubMed PubMed Central CAS Google Scholar
- Brunori E, Bernardini A, Moresi FV, Attorre F, Biasi R. Ecophysiological response of Vitis vinifera L. in an urban agrosystem: preliminary assessment of genetic variability. Plants. 2022;11:3026. https://doi.org/10.3390/plants11223026.Article PubMed PubMed Central CAS Google Scholar
- Salim BBM, Abou El-Yazied A, Salama YAM, Raza A, Osman HS. Impact of silicon foliar application in enhancing antioxidants, growth, flowering and yield of squash plants under deficit irrigation condition. Ann Agric Sci. 2021;66:176–83. https://doi.org/10.1016/j.aoas.2021.12.003.Article Google Scholar
- Malagoli M, Sut S, Kumar G, Dall’Acqua S. Variations of elements, pigments, amino acids and secondary metabolites in Vitis vinifera (L.) cv Garganega after 501 biodynamic treatment. Chem Biol Technol Agric. 2022;9:36. https://doi.org/10.1186/s40538-022-00299-y.Article CAS Google Scholar
- Chen T, Cai X, Wu X, Karahara I, Schreiber L, Lin J. Casparian strip development and its potential function in salt tolerance. Plant Signal Behav. 2011;6:1499–502. https://doi.org/10.4161/psb.6.10.17054.Article PubMed PubMed Central CAS Google Scholar
- Sienkiewicz-Cholewa U, Sumisławska J, Sacała E, Dziągwa-Becker M, Kieloch R. Influence of silicon on spring wheat seedlings under salt stress. Acta Physiol Plant. 2018;40:54. https://doi.org/10.1007/s11738-018-2630-y.Article CAS Google Scholar
- Cao B, Ma Q, Zhao Q, Wang L, Xu K. Effects of silicon on absorbed light allocation, antioxidant enzymes and ultrastructure of chloroplasts in tomato leaves under simulated drought stress. Sci Hortic (Amst). 2015;194:53–62. https://doi.org/10.1016/j.scienta.2015.07.037.Article CAS Google Scholar
- Muneer S, Park YG, Manivannan A, Soundararajan P, Jeong BR. Physiological and proteomic analysis in chloroplasts of Solanum lycopersicum L. under silicon efficiency and salinity stress. Int J Mol Sci. 2014;15:21803–24. https://doi.org/10.3390/ijms151221803.Article PubMed PubMed Central CAS Google Scholar
- Abbas T, Balal RM, Shahid MA, Pervez MA, Ayyub CM, Aqueel MA, et al. Silicon-induced alleviation of NaCl toxicity in okra (Abelmoschus esculentus) is associated with enhanced photosynthesis, osmoprotectants and antioxidant metabolism. Acta Physiol Plant. 2015;37:6. https://doi.org/10.1007/s11738-014-1768-5.Article CAS Google Scholar
- Ali N, Schwarzenberg A, Yvin J-C, Hosseini SA. Regulatory role of silicon in mediating differential stress tolerance responses in two contrasting tomato genotypes under osmotic stress. Front Plant Sci. 2018;9:1475. https://doi.org/10.3389/fpls.2018.01475.Article PubMed PubMed Central Google Scholar
- Mahdieh M, Habibollahi N, Amirjani MR, Abnosi MH, Ghorbanpour M. Exogenous silicon nutrition ameliorates salt-induced stress by improving growth and efficiency of PSII in Oryza sativa L. cultivars. J Soil Sci Plant Nutr. 2015;15:1050–60. https://doi.org/10.4067/S0718-95162015005000073.Article CAS Google Scholar
- Horie Y, Ito H, Kusaba M, Tanaka R, Tanaka A. Participation of chlorophyll b reductase in the initial step of the degradation of light-harvesting chlorophyll a/b-protein complexes in arabidopsis. J Biol Chem. 2009;284:17449–56. https://doi.org/10.1074/jbc.M109.008912.Article PubMed PubMed Central CAS Google Scholar
- Hörtensteiner S, Kräutler B. Chlorophyll breakdown in higher plants. Biochim Biophys Acta Bioenerg. 2011;1807:977–88. https://doi.org/10.1016/j.bbabio.2010.12.007.Article CAS Google Scholar
- Pružinská A, Tanner G, Anders I, Roca M, Hörtensteiner S. Chlorophyll breakdown: pheophorbide a oxygenase is a Rieske-type iron–sulfur protein, encoded by the accelerated cell death 1 gene. Proc Natl Acad Sci. 2003;100:15259–64. https://doi.org/10.1073/pnas.2036571100.Article PubMed PubMed Central CAS Google Scholar
- Armstrong GA, Hearst JE. Genetics and molecular biology of carotenoid pigment biosynthesis. FASEB J. 1996;10:228–37. https://doi.org/10.1096/fasebj.10.2.8641556.Article PubMed CAS Google Scholar
- Guillory A, Bonhomme S. Phytohormone biosynthesis and signaling pathways of mosses. Plant Mol Biol. 2021;107:245–77. https://doi.org/10.1007/s11103-021-01172-6.Article PubMed CAS Google Scholar
- Mostofa MG, Li W, Nguyen KH, Fujita M, Tran L-SP. Strigolactones in plant adaptation to abiotic stresses: an emerging avenue of plant research. Plant Cell Environ. 2018;41:2227–43. https://doi.org/10.1111/pce.13364.Article PubMed CAS Google Scholar
- Rémus-Borel W, Menzies JG, Bélanger RR. Silicon induces antifungal compounds in powdery mildew-infected wheat. Physiol Mol Plant Pathol. 2005;66:108–15. https://doi.org/10.1016/j.pmpp.2005.05.006.Article CAS Google Scholar
- Tripathi DK, Singh S, Singh VP, Prasad SM, Chauhan DK, Dubey NK. Silicon nanoparticles more efficiently alleviate arsenate toxicity than silicon in maize cultiver and hybrid differing in arsenate tolerance. Front Environ Sci. 2016;4:46. https://doi.org/10.3389/fenvs.2016.00046.Article Google Scholar
- Fawe A, Abou-Zaid M, Menzies JG, Bélanger RR. Silicon-mediated accumulation of flavonoid phytoalexins in cucumber. Phytopathology®. 1998;88:396–401. https://doi.org/10.1094/PHYTO.1998.88.5.396.Article PubMed CAS Google Scholar
- Rodrigues FÁ, Benhamou N, Datnoff LE, Jones JB, Bélanger RR. Ultrastructural and cytochemical aspects of silicon-mediated rice blast resistance. Phytopathology®. 2003;93:535–46. https://doi.org/10.1094/PHYTO.2003.93.5.535.Article PubMed CAS Google Scholar
- Sharma A, Shahzad B, Rehman A, Bhardwaj R, Landi M, Zheng B. Response of phenylpropanoid pathway and the role of polyphenols in plants under abiotic stress. Molecules. 2019;24:2452. https://doi.org/10.3390/molecules24132452.Article PubMed PubMed Central CAS Google Scholar
- Collinge DB, Kragh KM, Mikkelsen JD, Nielsen KK, Rasmussen U, Vad K. Plant chitinases. Plant J. 1993;3:31–40. https://doi.org/10.1046/j.1365-313X.1993.t01-1-00999.x.Article PubMed CAS Google Scholar
- Flach J, Pilet P-E, Jollès P. What’s new in chitinase research? Experientia. 1992;48:701–16. https://doi.org/10.1007/BF02124285.Article PubMed CAS Google Scholar
- Robert N, Roche K, Lebeau Y, Breda C, Boulay M, Esnault R, et al. Expression of grapevine chitinase genes in berries and leaves infected by fungal or bacterial pathogens. Plant Sci. 2002;162:389–400. https://doi.org/10.1016/S0168-9452(01)00576-3.Article CAS Google Scholar
- Trotel-Aziz P, Couderchet M, Vernet G, Aziz A. Chitosan stimulates defense reactions in grapevine leaves and inhibits development of botrytis cinerea. Eur J Plant Pathol. 2006;114:405–13. https://doi.org/10.1007/s10658-006-0005-5.Article CAS Google Scholar
- Sattar A, Cheema MA, Sher A, Ijaz M, Ul-Allah S, Nawaz A, et al. Physiological and biochemical attributes of bread wheat (Triticum aestivum L.) seedlings are influenced by foliar application of silicon and selenium under water deficit. Acta Physiol Plant. 2019;41:146. https://doi.org/10.1007/s11738-019-2938-2.Article CAS Google Scholar
- Coskun D, Deshmukh R, Sonah H, Menzies JG, Reynolds O, Ma JF, et al. The controversies of silicon’s role in plant biology. New Phytol. 2019;221:67–85. https://doi.org/10.1111/nph.15343.Article PubMed Google Scholar
- Santini G, Bianchi A, Pettinelli S, Modesti M, Cerreta R, Bellincontro A. Air speed and plastic crate vent-holes for wine grape quality during postharvest dehydration: commercial and laboratory studies. J Sci Food Agric. 2023. https://doi.org/10.1002/jsfa.12817.Article PubMed Google Scholar