Résumé d’un article de Mazzei et al. publié en septembre 2024 dans la revue Chemical and Biological Technologies in Agriculture volume 11, Article number: 137 (2024). DOI : https://doi.org/10.1186/s40538-024-00620-x.
Titre original : MRI and HR-MAS NMR spectroscopy to correlate structural characteristics and the metabolome of Fiano and Pallagrello grapes with the action of field spray preparation 500 and the soil spatial microvariability.
Environ 7,5 millions d’hectares de sols fertiles dans le monde sont consacrés à la culture de Vitis vinifera et sont principalement concentrés en Chine, en Italie, aux États-Unis, en France, en Espagne et en Turquie1. Plus de 93 % de ces vignobles sont composés de cépages produisant des raisins de qualité adaptés à l’industrie vinicole. L’Italie représente le deuxième producteur mondial de vin, après la France, avec une production moyenne en 2021 de plus de 50,2 millions d’hectolitres2. D’un point de vue qualitatif, de nombreux vins italiens sont classés comme excellents, comme le prouve l’attribution de 329 D.O.C. (Appellation d’Origine Contrôlée) et de 70 prestigieux labels de qualité D.O.C.G. (Appellation d’Origine Contrôlée et Garantie)3. Les producteurs de raisin et de vin s’intéressent donc beaucoup à l’identification de stratégies agronomiques novatrices et de conditions pédologiques avantageuses permettant d’améliorer la productivité de la vigne et de promouvoir l’obtention de raisins de qualité et excellents.
Dans cette perspective, l’utilisation de biostimulants efficaces peut favoriser la croissance des vignes et augmenter leur capacité à faire face aux facteurs négatifs affectant leur physiologie et leurs performances, tels que la carence en nutriments du sol et en eau, les attaques de pathogènes et les conditions microclimatiques défavorables. En fait, les biostimulants peuvent activer des mécanismes provoquant une réponse chez les vignes, ce qui les rend plus efficaces dans l’exploitation des ressources du sol4-7. Il convient de noter que des biostimulants organiques efficaces peuvent contribuer à atténuer les effets néfastes des changements climatiques incessants8. Les produits biodynamiques, qui sont obtenus dans le respect des principes de l’économie circulaire et de la durabilité, peuvent représenter des candidats appropriés à cette fin. Par exemple, il a été prouvé que l’application d’un traitement biodynamique sur le sol et les vignes peut améliorer la production et la qualité du raisin, ce qui représente une approche alternative aux méthodes traditionnelles souvent responsables de la détermination des impacts environnementaux pertinents9,10. En particulier, la préparation pour pulvérisation 500 (p500) est un produit organique issu de la stabilisation biochimique du fumier de vache, réalisée dans le respect des principes biodynamiques11. Ce produit a une structure moléculaire complexe, avec un faible comportement hydrophobe et composé principalement de dérivés aromatiques, de polysaccharides et de composés d’alkyle12. Il a été prouvé que l’application de p500 peut avoir une influence positive sur le blé en favorisant la croissance des plantes et des racines et en augmentant la vigueur des semis13. Récemment, un modèle développé sur la base de la résonance magnétique nucléaire (RMN) à l’état liquide du proton prouve que la composition moléculaire des raisins, cultivés selon une méthode biodynamique incluant le traitement au p500, présente un profil significativement différent de celui des raisins issus d’une gestion biologique traditionnelle14. Cependant, jusqu’à présent, la littérature sondant l’efficacité du p500 en tant que biostimulant biodynamique est encore peu abondante. D’autres études sont donc nécessaires pour confirmer et consolider le rôle bénéfique et efficace de ce produit.
D’autre part, il existe un intérêt croissant pour l’utilisation de méthodes rapides, fiables et géoréférençables afin de mieux comprendre les corrélations existantes entre la qualité du vin et les propriétés caractérisant le territoire d’origine du raisin. Dans ce contexte, la méthode de l’induction électromagnétique (IEM), typiquement adoptée pour l’agriculture de précision, représente une technique très prometteuse permettant l’évaluation de la conductivité électrique apparente du sol (ECa) et sa représentation par des cartes intuitives et réactives. L’IEM est très avantageuse car elle permet de prédire plusieurs conditions et propriétés du sol, telles que la teneur en eau, en matière organique, en argiles actives et en sels, ainsi que d’identifier les roches enfouies à une profondeur de sol qui, selon la fréquence choisie pour la mesure, peut aller jusqu’à 1,5-2 m15, 16. Conceptuellement, la technique IEM implique la génération d’un champ magnétique primaire, développé à partir d’un émetteur mobile et orienté vers le sol. La présence de composants conducteurs dans le sol produit des courants secondaires qui, à leur tour, génèrent un champ magnétique secondaire induit. La détection et la quantification de ce dernier sont finalement exploitées pour extrapoler la conductivité électrique du sol15-17. Récemment, les cartes ECa ont également été utilisées pour corréler la variabilité spatiale des propriétés physiques du sol avec les réponses des cultures spécifiques au site, y compris les paramètres biologiques18 et la respiration totale du sol19. Il a été constaté que les paramètres de croissance des plantes, tels que la hauteur, l’indice de surface foliaire et la matière sèche, sont bien corrélés avec les schémas pédologiques identifiés par les cartes ECa pour des cultures telles que l’orge d’hiver, le blé d’hiver et la betterave sucrière20. De même, une relation étroite entre les cartes ECa et la hauteur des plants de maïs a récemment été établie dans le cadre d’expériences sur le terrain21. Une corrélation significative a également été trouvée entre la microvariabilité du sol, détectée par IEMet la qualité moléculaire des raisins Aglianicone dans différents vignobles22.
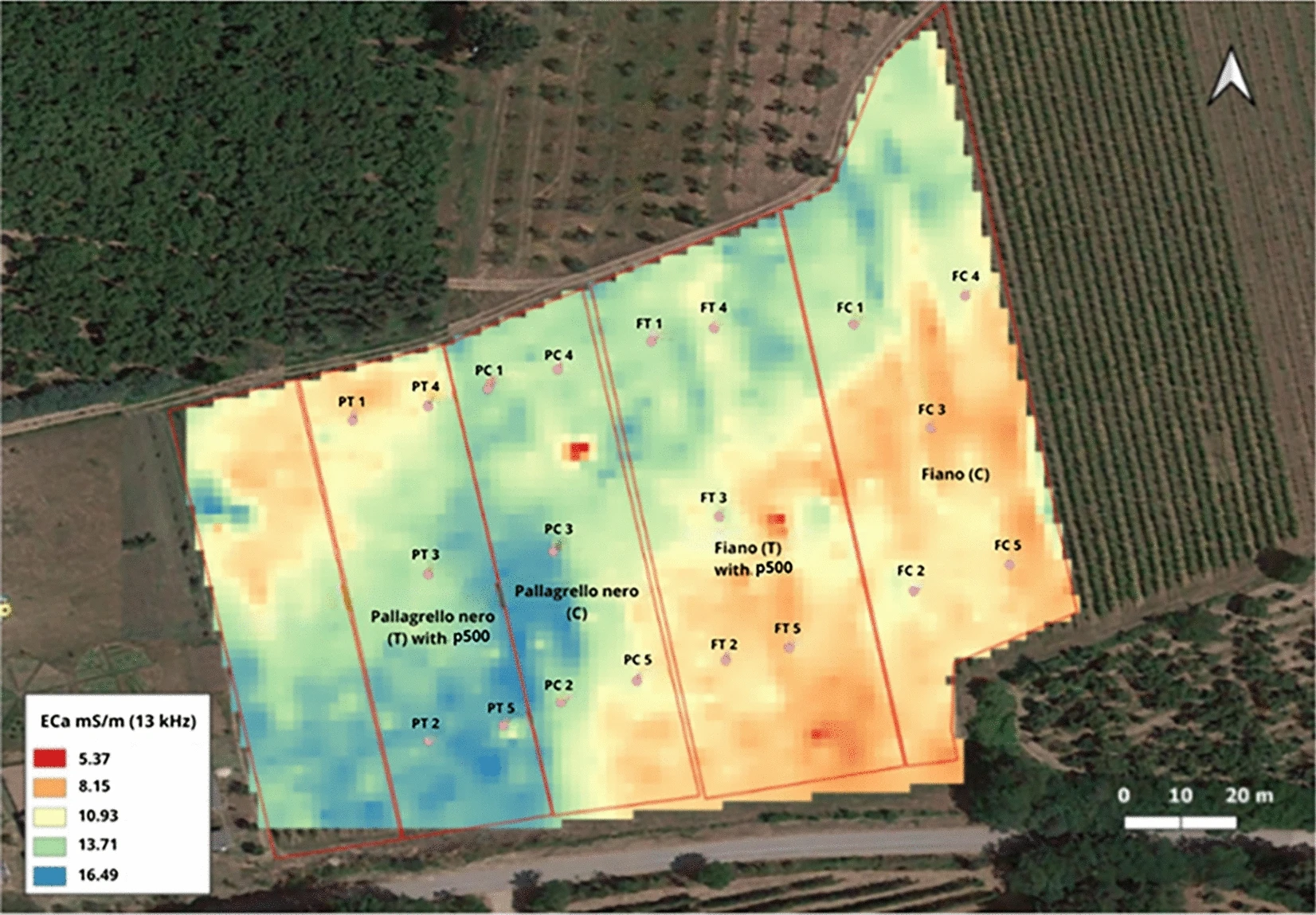
Sur cette base, l’objectif de ce travail était d’étudier les effets possibles induits par le traitement p500 sur des variétés vignes italiennes autochtones (Pallagrello Nero et Fiano), lors d’essais en plein champ, en tenant compte également de la microvariabilité spatiale des vignobles, révélée par la méthode EIM. L’influence du traitement p500 et de la microvariabilité du sol a été vérifiée en examinant (i) des paramètres nutraceutiques représentatifs ; (ii) le métabolome primaire ; et (iii) la microstructure et les traits morphologiques des raisins étudiés.
En particulier, le métabolome du raisin a été élucidé au moyen de la spectroscopie RMN par rotation à angle magique à haute résolution (HRMAS), à l’état semi-solide23,24. Cette technique permet d’obtenir des spectres RMN par l’examen direct de tissus frais et intacts, de manière relativement rapide, avec une résolution très similaire à celle que l’on peut obtenir par RMN haute résolution à l’état liquide23,25. La HRMAS représente une technique très innovante et puissante qui a déjà été utilisée avec succès, principalement pour étudier la qualité et l’origine de produits agroalimentaires importants, tels que la tomate26, le kaki27, le poivron28 et le maïs29. Cependant, malgré son potentiel incontestable, le HRMAS est encore sous-utilisé dans les domaines de la chimie alimentaire et agricole, alors qu’il serait utile d’explorer son potentiel inexprimé.
L’analyse de la microstructure et des caractères morphologiques du raisin a été réalisée au moyen de l’imagerie par résonance magnétique30-32. Cette technique est basée sur la quantification et la localisation spatiale des protons de l’eau et permet l’acquisition d’images morphologiques détaillées (résolution de dizaines de micromètres) de coupes internes de tissus intacts. En outre, l’adoption d’expériences spécifiques permet d’extrapoler des informations multiples et complémentaires qui renseignent directement sur la composition et la dynamique des molécules d’eau dans le tissu examiné et indirectement sur la microstructure de l’échantillon30,33. À ce jour, l’IRM a été utilisée pour examiner plusieurs aspects importants de produits agroalimentaires pertinents, tels que la tomate34, 35, le radis 36, le kiwi33, 37, 38 et la pomme39-41. L’IRM est une technique d’imagerie très puissante qui, jusqu’à présent, a été largement utilisée dans les domaines de la diagnostique médicale et de la pharmacologie. Toutefois, à l’instar des HRMAS, le potentiel de l’IRM dans les domaines de la chimie alimentaire et agricole est encore sous-utilisé. Par conséquent, un autre objectif de ce travail était de révéler et de démontrer l’adéquation et le rôle potentiel de l’IRM et de la spectroscopie RMN HRMAS pour enquêter sur les raisins et fournir des informations utiles.
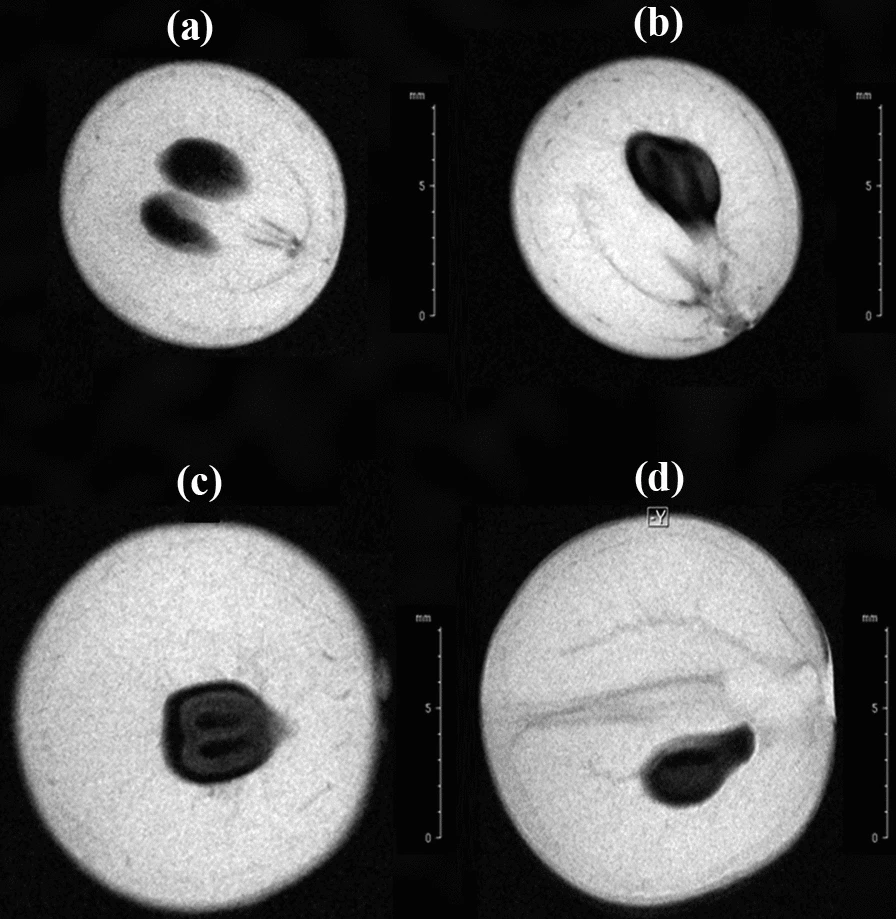
L’IRM a été utilisée pour examiner la morphologie interne des baies intactes des cultivars Fiano et Pallagrello. La figure ci-dessus montre les images IRM relatives aux tranches centrales de baies de raisin représentatives du Fiano (a) et du Pallagrello Nero (b). Les images IRM ont clairement permis de distinguer les trois principaux tissus morphologiques composant ce fruit. En effet, la fine couche externe plus foncée est composée de l’exocarpe et de l’épiderme, tandis que le mésocarpe correspond à la grande zone occupée par des signaux intenses et blanchâtres dus à la forte teneur en eau. Les graines sont clairement identifiables dans l’endocarpe par la présence de zones sombres semi-ellipsoïdales, caractérisées par une zone relativement plus sombre et externe (le tégument) et une zone relativement grisâtre et plus claire (l’endosperme contenu dans les graines). Ces dernières apparaissent nettement plus foncées que le tissu mésocarpique environnant, car elles sont plus pauvres en eau et plus riches en huiles et en polyphénols. En outre, il a également été possible d’apprécier le système vasculaire et, en particulier, les faisceaux vasculaires périphériques, se ramifiant à proximité de l’exocarpe, les faisceaux fibrovasculaires centraux, se développant sous la cercine, et les faisceaux directement connectés aux graines. Ces images suggèrent que l’IRM peut révéler des détails anatomiques d’échantillons intacts in vivo ou ex vivo, avec une résolution de dizaines de microns. Ceci est important car cela ouvre la voie à son utilisation pour étudier la détection précoce des effets liés au traitement sur les caractéristiques morphologiques internes du raisin. […] Bien que cela prouve le rôle potentiel de l’IRM dans l’étude des raisins, d’un autre côté, cela certifie que le potentiel de l’IRM pour examiner les raisins est encore largement inexprimé et inexploré, ce qui nécessite d’autres validations. Tout d’abord, les images IRM de F et de P ont été comparées avec précision. Seules des différences morphométriques appréciables ont été observées entre les deux variétés, le diamètre et le volume des baies et des graines de P (détectées dans les baies entières) apparaissant significativement plus grands que ceux des raisins de F. Cependant, d’un point de vue qualitatif et morphologique, aucune différence pertinente et reproductible n’a été appréciée en fonction du traitement p500 et de la conductivité électrique du sol.
Conclusions
Dans ce travail, nous avons utilisé une approche analytique innovante pour vérifier l’impact possible exercé sur les fruits du raisin par l’application du biostimulant biodynamique p500 et en tenant compte de la diversité territoriale du vignoble révélée par la conductivité électrique du sol. Nous nous sommes concentrés sur deux variétés de raisins très représentatives de la production italienne de vins d’excellence, à savoir le Pallagrello Nero et le Fiano, et avons évalué (i) le métabolome primaire des raisins par RMN HRMAS ; (ii) les principaux paramètres représentatifs de la qualité chimique et nutraceutique des raisins (acidité titrée ; teneur en phénols totaux et en polyphénols par FOLIN ; teneur en composés antioxydants par DPPH) ; (iii) les caractéristiques microstructurales et morphologiques des raisins par IRM. Il convient de souligner que l’utilisation de la RMN HRMAS et de l’IRM représente une innovation technologique pertinente. En effet, malgré leur capacité indiscutable à permettre l’analyse RMN d’échantillons frais et intacts sans recourir à des manipulations préliminaires de l’échantillon, elles restent inexplicablement inexplorées et sous-estimées dans le domaine de la chimie alimentaire.
Ce travail a confirmé la validité et la fiabilité de la technique HRMAS dans l’analyse des baies de raisin. En effet, il a permis de détecter le métabolome primaire des raisins Fiano et Pallagrello, en identifiant les principaux acides aminés, l’alcool, les acides organiques, les hydrates de carbone et les composés azotés liés au métabolisme primaire des raisins. L’élaboration des spectres de protons des différents types de raisins étudiés à l’aide de techniques statistiques avancées et multivariées a prouvé, objectivement, que l’application correcte du biostimulant p500 influence le métabolisme primaire des plantes, avec des effets qui affectent le métabolisme primaire du raisin. En outre, les baies de raisin récoltées dans des vignobles caractérisés par des valeurs ECa différentes présentent un métabolisme systématiquement différent. Ces facteurs ont également eu un impact significatif sur les paramètres chimiques et nutritionnels. En particulier, les valeurs nutraceutiques les plus élevées ont été enregistrées pour les raisins Pallagrello et Fiano, tous deux traités avec le p500 et collectés à des points caractérisés par des valeurs ECa faibles et élevées, respectivement. En effet, le premier contenait 1,76 mg GAE/g et 3372,45 µg AAE/g, tandis que le second contenait 0,89 mg GAE/g et 1717,97 µg AAE/g. Ce qui est important, c’est que cela prouve que, dans certaines conditions de sol, la p500 biodynamique peut améliorer de manière significative la qualité nutritionnelle de ce fruit.
L’IRM a non seulement permis d’examiner les principales caractéristiques structurelles des baies de raisin entières, mais aussi d’extrapoler d’importantes données sur les paramètres de l’eau, telles que les temps de relaxation des protons et les coefficients de diffusion, qui se sont révélés être en corrélation avec l’application de p500 et la conductivité électrique du sol. On a émis l’hypothèse que ces variations dans le raisin reflétaient les conditions biotiques et abiotiques rencontrées par la vigne au cours du développement des fruits examinés, telles que les différentes disponibilités en eau et en nutriments dans les sols, l’action exercée par le p500 en tant qu’amorce pour modifier et enrichir la communauté microbienne au niveau de la rhizosphère et ainsi de suite. Il convient de noter que les résultatsT2 ont montré une tendance très similaire à celle des coefficients de diffusion et que les valeurs élevées sont en corrélation avec la teneur la plus élevée en phénols totaux et en antioxydants. Ce résultat confirme que les données paramétriques de l’IRM constituent un marqueur potentiel de la qualité nutritionnelle du raisin. Toutefois, comme l’a démontré l’application de l’IRM aux raisins P, une des limites de la méthode est qu’elle ne peut être appliquée, de manière fiable, qu’aux variétés de raisin capables de rester principalement à l’air libre à 25 °C pendant au moins 8 heures (comme le Fiano).
En conclusion, nos résultats ont montré comment la microvariabilité spatiale du sol et l’utilisation du p500 peuvent affecter les caractéristiques moléculaires, structurelles et nutritionnelles des raisins Pallagrello Nero et Fiano, avec des effets qui peuvent vraisemblablement se refléter sur la qualité des vins qui en résultent.
L’approche proposée représente une solution efficace pour valoriser indirectement les raisins et les vins biodynamiques. En outre, le profil métabolique identifié des raisins p500 peut servir d’outil utile pour aider les producteurs biodynamiques à (i) promouvoir leurs produits par le biais de la traçabilité moléculaire, (ii) contrer les fraudes éventuelles et, surtout, (iii) démontrer objectivement l’utilisation du traitement biodynamique indiqué.
Références
- Khan N, Fahad S, Faisal S, Naushad M. Grape production critical review in the world. SSRN Electron J. 2020. https://doi.org/10.2139/ssrn.3595842.
- Vinci G, Prencipe SA, Abbafati A, Filippi M. Environmental impact assess- ment of an organic wine production in central Italy: case study from Lazio. Sustainability. 2022;14(22):15483.
- Dordevic N, Wehrens R, Postma GJ, Buydens LMC, Camin F. Statistical methods for improving verification of claims of origin for Italian wines based on stable isotope ratios. Anal Chim Acta. 2012;757:19–25.
- Pereira GE, Gaudillere J-P, Pieri P, Hilbert G, Maucourt M, Deborde C, Moing A, Rolin D. Microclimate influence on mineral and metabolic profiles of grape berries. J Agric Food Chem. 2006;54(18):6765–75.
- Asselin C, Morlat R, Barbeau G. Le Terroirs Viticoles: du concept au produit. Terroir, Zonazione, Viticoltura. Phytoline ED, Rivoli Veronese (VR). 2003. p. 159–86.
- Bulgari R, Franzoni G, Ferrante A. Biostimulants application in horticultural crops under abiotic stress conditions. Agronomy. 2019;9:306.
- Tangolar S, Tangolar S, Canturk S. The role of biostimulants in viticulture. In: Current agricultural studies in Türkiye: research and reviews. Ankara: IKSAD Publishing House; 2022. p. 203–27.
- Fallahi HR, Taherpour R, Aghhavani-Shajari M, Soltanzadeh MG. Effect of super absorbent polymer and deficit irrigation on water use efficiency, growth and yield of cotton. Not Sci Biol. 2015;7(3):338–44.
- Bernardo S, Dinis LT, Machado N, Moutinho-Pereira J. Grapevine abiotic stress assessment and search for sustainable adaptation strategies in Mediterranean-like climates. A review. Agron Sustain Dev. 2018;38(6):1–20.
- Vazquez-Rowe R, Moreira MT, Villanueva-Rey P, Feijoo G. Comparative life cycle assessment in the wine sector: biodynamics vs conventional viticulture activities in NW Spain. J Clean Prod. 2013;65:330–41.
- Steiner R. Agriculture: a course of eight lectures. London: Biodynamic Agricultural Association; 1972.
- Spaccini R, Mazzei P, Squartini A, Giannattasio M, Piccolo A. Production of the BD preparation 500, molecular properties of a fermented manure preparation used as field spray in biodynamic agriculture. Environ Sci Pollut Res. 2012;19:4214–25.
- Reeve JR, Carpenter-Boggs L, Reganold JP, York AL, Brinton WF. Summary and conclusion, influence of biodynamic preparations on compost development and resultant compost extracts on wheat seedling growth. Bioresour Technol. 2010;5665:5658–66.
- Picone G, Trimigno A, Tessarin P, Donnini S, Rombolà AD, Capozzi F. 1H NMR foodomics reveals that the biodynamic and the organic culti- vation managements produce different grape berries. Food Chem. 2016;213:187–95.
- Davis JG, Kitchen NR, Sudduth KA, Drummond ST. Using electromagnetic induction to characterize soils. Better Crops; 1997. p. 6–8.
- Doolitle JA, Brevik EC. The use of electromagnetic induction techniques in soils studies. Geoderma. 2014;223:33–45.
- Misra RK, Padhi J. Assessing field-scale soil water distribution with electro- magnetic induction method. J Hydrol. 2014;516:200–9.
- Lardo E, Coll P, Le Cadre E, Palese AM, Villenave C, Xiloyannis C, Celano G. Electromagnetic induction (EMI) measurements as a proxy of earthworm presence in southern France vineyard. Appl Soil Ecol. 2012;61:76–84.
- Lardo E, Palese AM, Nuzzo V, Xiloyannis C, Celano G. Variability of total soil respiration in a Mediterranean vineyard. Soil Res. 2015;53:531–41.
- Stadler A, Rudolph S, Kupisch M, Langensiepen M, Van der Kruk J, Ewert F. Quantifying the effects of soil variability on crop growth using apparent soil electrical conductivity measurements. Eur J Agron. 2015;64:8–20.
- Rudolph S, Wongleecharoen C, Lark RM, Marchant BP, Garré S, Herbst M, Weihermuller L. Soil apparent conductivity measurements for planning and analysis of agricultural experiments: a case study from western- Thailand. Geoderma. 2016;267:220–9.
- Mazzei P, Celano G, Palese AM, Lardo E, Drosos M, Piccolo A. HRMAS- NMR metabolomics of Aglianicone grapes pulp to evaluate terroir T and vintage effects, and as assessed by the electromagnetic induc- tion (EMI) technique, spatial variability of vineyard soils. Food Chem. 2019;216:215–23.
- Doty FD, Entzminger G, Yang AY. Magnetism in high-resolution NMR probe design. II: HR MAS. Concepts Magn Reson Educ J. 1998;10:239–60.
- Mazzei P, Piccolo A. HRMAS NMR spectroscopy applications in agriculture. In: Chemical and biological technologies in agriculture. Heidelberg: Springer; 2017. p. 1–13.
- Mazzei P, Piccolo A, Valentini M. Intact food analysis by means of HRMAS- NMR spectroscopy. In: Webb GA, editor. Modern magnetic resonance. Cham: Springer; 2017. p. 1–16.
- Mazzei P, Vinale F, Woo SL, Pascale A, Lorito M, Piccolo A. Metabolomics by proton high-resolution magic-angle-spinning nuclear magnetic reso- nance of tomato plants treated with two secondary metabolites isolated from trichoderma. J Agric Food Chem. 2016;64:3538–45.
- Santos ADDC, Fonseca FA, Dutra LM, Santos MFC, Menezes LRA, Campos FR, Nagata N, Ayub R, Barison A. 1H HR-MAS NMR-based metabolomics study of different persimmon cultivars (Diospyros kaki) during fruit devel- opment. Food Chem. 2018;239:511–9.
- Ritota M, Marini F, Sequi P, Valentini M. Metabolomic characterization of Italian sweet pepper (Capsicum annum L.) by means of HRMAS- NMR spectroscopy and multivariate analysis. J Agric Food Chem. 2010;58(17):9675–84.
- Mazzei P, et al. High-resolution magic-angle-spinning NMR and mag- netic resonance imaging spectroscopies distinguish metabolome and structural properties of maize seeds from plants treated with differ- ent fertilizers and arbuscular mycorrhizal fungi. J Agric Food Chem. 2018;66(11):2580–8.
- Hills B. Magnetic resonance imaging in food science. New York: Wiley; 1998.
- Mannina L, Mazzei P, et al. Spettroscopia in Risonanza Magnetica Nucle- are nelle scienze degli alimenti. Zanichelli. 2023.
- Mannina L, Sobolev A, Proietti M, Capitani D, Mazzei P, Piccolo A, et al. NMR methodologies in food analysis. In: Analytical chemistry: develop- ments, applications, and challenges in food analysis. New York: Nova Science Publishers, Inc.; 2017. p. 103–56.
- Valentini M, Sequi P, Ciampa A, Ritota M, Taglienti A, Cozzolino S, Conte L, Terlizzi M. Qualità tramite Risonanza Magnetica per Immagini: valutazi- one della conservazione e dei trattamenti agronomici. Italus Hortus. 2009;16(5):324–8.
- Sequi P, Dell’Abate MT, Valentini M. Identification of cherry tomatoes growth origin by means of magnetic resonance imaging. J Sci Food Agric. 2007;87:127–32.
- Ciampa A, Dell’Abate MT, Masetti O, Valentini M, Sequi P. Seasonal chemical–physical changes of PGI Pachino cherry tomatoes detected by magnetic resonance imaging (MRI). Food Chem. 2010;122:1253–60.
- Salerno A, Pierandrei F, Rea E, Sequi P. Definition of internal morphology and structural changes due to dehydration of radish (Raphanus sativus L. cv Suprella) using magnetic resonance imaging spectroscopy. J Food Qual. 2005;28:428–38.
- Taglienti A, Sequi P, Cafiero C, Cozzolino S, Ritota M, Ceredi G, Valentini M. Hayward Kiwifruits and plant growth regulators: detection and effects in post-harvest studied by magnetic resonance imaging and scanning electron microscopy. Food Chem. 2011;126(2):731–6.
- Kerr WL, Clark CJ, McCarthy MJ, de Ropp JS. Freezing effects in fruit tissue of kiwifruit observed by magnetic resonance imaging. Sci Hortic. 1997;69:169–79.
- Wang SY, Wang PC, Faust M. The non-destructive detection of water- core in apple with nuclear magnetic resonance imaging. Sci Hortic. 1988;35:227–34.
- Clark CJ, MacFall JS, Bieleski RL. Loss of watercore from ‘Fuji’ apple observed by magnetic resonance imaging. Sci Hortic. 1998;73:213–27.
- Melado Herreros A, Munoz-García MA, Blanco A, Val J, Fernandez Valle ME, Barreiro Elorza P. Relationship between solar radiation on watercore on apple fruit assessed with MRI. In: International conference of agricultural engineering. 2012. p. 1–5.